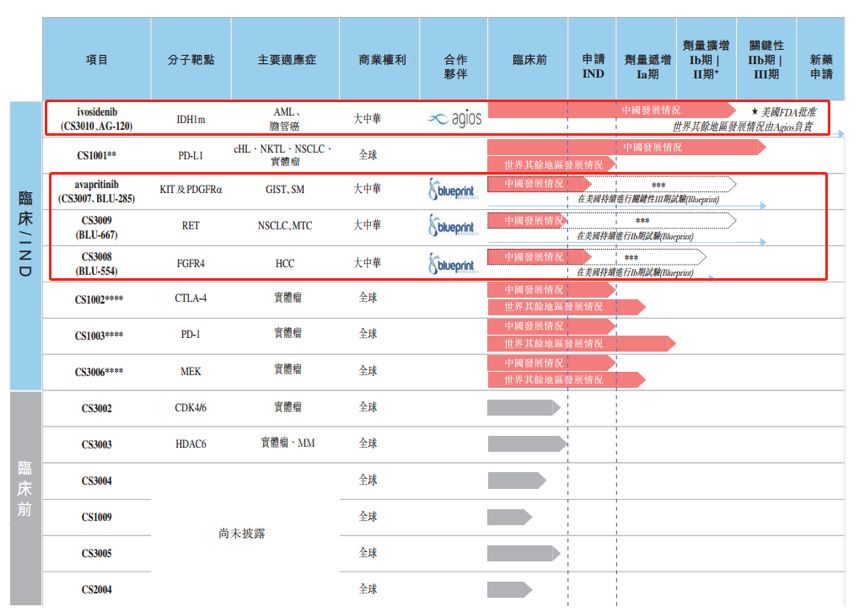
根據聆訊資料,2018年6月,公司分別與Agios及Blueprint訂立獨家許可及合作協議,在大中華地區開發及商業化四種分子靶向化合物,并向其支付許可費。其中,與Agios合作的ivosidenib(CS3010、AG-120)處于劑量擴增Ib/Ⅱ臨床試驗期,而與Blueprint合作的三種化合物在中國的發展進程還處于臨床研究(IND)申請階段。以下為公司候選藥物情況:
梳理了基石藥業的基本情況,經營期限、招股前投資、營運資本和市值這五項似乎都可以滿足要求。
有爭議的地方或許在于研發外包所獲候選產品是否能滿足“擁有至少一支核心產品、且已經通過概念階段”。
港交所對上市規則的修訂中,并沒有明文規定核心產品研發是否可以外包。如果基石藥業能夠被放行,則意味著研發外包的模式獲得了港交所的認可。
果真如此,那這是一個相當重要的信號,這或許意味著打開了一條參照新規“量身定制”的通道。
對比新政的五項標準,如果有大資本加持,招股前投資、營運資本和市值都不難滿足,經營期限,數日子即可,真正門檻比較高的實際上是“核心產品”。而一旦外包模式獲得認可,這意味著定制包裝的難度大大降低。
更多資訊,關注財經365股票頻道!
